มนุษยพันธุศาสตร์ในยุคจีโนมิกส์ (Human Genetics in the Genomic Era)
มนุษยพันธุศาสตร์ –
ความหมายและวิวัฒนาการทางความรู้
“มนุษยพันธุศาสตร์”
เป็นวิชาที่ว่าด้วยศึกษาพันธุกรรมและการเปลี่ยนแปลงทางพันธุกรรมของมนุษย์
พันธุศาสตร์ (รวมทั้งมนุษยพันธุศาสตร์) ได้รับการวางรากฐานจากการค้นพบของบาทหลวง
เกร์เกอร์ โจฮานน์ เมนเดล (Gregor Johann Mendel) ชาวออสเตรีย
“บิดาแห่งพันธุศาสตร์“ ผู้ค้นพบกฎการถ่ายทอดทางพันธุกรรม ตั้งแต่ปี ค.ศ. 1865
พันธุศาสตร์เป็นแก่นของชีววิทยาและชีววิทยาประยุกต์ทุกสาขาและยังเป็นพื้นฐานสำคัญของทฤษฎีวิวัฒนาการ
(The Evolution Theory) ซึ่งค้นพบและเผยแพร่มาก่อนหน้าโดย ชาร์ล ดาร์วิน (Charles
Darwin) นับแต่ปี ค.ศ. 1859
คำว่า “พันธุศาสตร์” หรือ
“genetics” ในภาษาอังกฤษ ปรากฏขึ้นครั้งแรก ในปี ค.ศ. 1904 โดยวิล-เลี่ยม เบทสัน
(William Bateson) ผู้คิดค้นใช้คำนี้
เพื่อเรียกการศึกษาพันธุกรรมและความผันแปรทางพันธุกรรม ส่วนคำว่า “ยีน”
(gene)” มาจากวิลเฮล์ม โจฮานเซน (Wilhelm Johannsen) นักพฤกษศาสตร์ชาวแดนิช ในปี
ค.ศ. 1909 ตั้งขึ้นเพื่อเรียกหน่วยพันธุกรรมที่ค้นพบโดย เมนเดล ( Mendelian units
of heredity) นอกจากจะเป็นผู้กำหนดคำสำหรับเรียกลักษณะที่ปรากฏภายนอกว่า “ฟีโนทัยป์
(phenotype)” และเรียกลักษณะทางพันธุกรรมที่เป็นตัวกำหนดว่า “จีโนทัยป์ (genotype)”
คำว่ายีนนี้ มาจากคำว่า “จีโนส (genos)” ในภาษากรีกซึ่งแปลว่า “เกิด (birth)”
อันเป็นที่มาของคำว่า “จีโนม (genome)” ในปัจจุบันด้วย
วิชาพันธุศาสตร์มีประวัติและวิวัฒนาการที่ยาวนานมากกว่า 140 ปี
และมีความก้าวหน้าจากการค้นพบอย่างต่อเนื่องของนักชีววิทยาจำนวนมาก
มนุษย์พันธุศาสตร์ก็มีประวัติอันยาวนานควบคู่มากับพันธุศาสตร์นับตั้งแต่ยุคแรก
ดังในปี ค.ศ. 1869 ฟริดิช ไมส์เชอร์ (Friedich Miescher) แยกดีเอ็นเอ็นเอ (DNA)
ได้เป็นครั้งแรก เรียกว่า “นิวคลีอิน (nuclein)” จากเซลล์เม็ดเลือดขาวของมนุษย์
โดยใช้ตัวอย่างจากหนองฝี (pus) ซึ่งเก็บมาจากผ้าพันแผลของผู้ป่วยจากโรงพยาบาล
ในปีนั้นเอง ฟรานซีส แกลตัน (Francis Galton)
ก็ได้ตีพิมพ์ผลงานทางวิทยาศาสตร์การศึกษาพงศาวลีของมนุษย์ (human pedigree)
และสรุปว่าสติปัญญามีพันธุกรรมเป็นพื้นฐาน ต่อมาในปี ค.ศ. 1902 อาร์ชิบาลด์ เกร็อด
(Archibald Garod) เป็นผู้รายงานโรคพันธุกรรมโรคแรกในมนุษย์ คือ โรคอัลแคปโตนูเรีย
(alkatonuria) โดยแสดงให้เห็นว่าโรคนี้มีการถ่ายทอดทางพันธุกรรมตามหลักของเมนเดล
(แม้ว่าจะเป็นโรคที่พบได้ยาก อาการสำคัญของโรค คือ ข้ออักเสบและปัสสาวะสีดำ)
นับได้ว่า อาร์ชิบาลด์ เกร็อค เป็นผู้วางรากฐานของวิชาพันธุศาสตร์เชิงชีวเคมี
(Biochemical Genetics) คนแรก
การวิเคราะห์การถ่ายทอดร่วมทางพันธุกรรม (genetic linkage analysis)
ซึ่งใช้กันแต่อดีตถึงปัจจุบัน ทั้งในมนุษย์ พืช และสัตว์ เริ่มต้นจากผลงานของ โธมัส
ฮันท์ มอร์แกน (Thomas Hunt Morgan) แห่งมหาวิทยาลัยโคลัมเบีย
ซึ่งศึกษาในแมลงหวี่ (Drosophila melanogaster) นับแต่ปี ค.ศ. 1911
และเป็นผู้พบว่าโครโมโซมเป็นตัวถ่ายทอดยีน
ซึ่งหลายยีนอาจจะมีการถ่ายทอดร่วมไปบนโครโมโซมเดียวกัน (genetic linkage)
เพราะมีการเรียงตัวบนโครโมโซมเป็นแถว และโครโมโซมอาจจะเกิดการไขว้เปลี่ยนกัน
(chromosome recombination) ได้ อัตราการไขว้เปลี่ยนจะเป็นบอกระยะถี่ห่างของยีน
มีหน่วยป็น “เซ็นติมอร์แกน (centi-Morgan หรือ cM)”
ซึ่งตั้งขึ้นเพื่อเป็นเกียรติแก่ท่าน ระยะ 1 เซ็นติมอร์แกน (cM)
เท่ากับระยะที่มีการไขว้เปลี่ยนของโครโมโซมได้ในอัตราร้อยละ 1
ในปัจจุบันประมาณได้เท่ากับจำนวน 1 ล้าน นิวคลีโอไทด์เบส หรือ 1 เม็กกะเบส
(megabase หรือ Mb) โธมัส ฮันท์ มอร์แกน ได้รับรางวัลโนเบลในปี ค.ศ.
1933
ข้อพิสูจน์ว่าสารพันธุกรรมเป็นดีเอ็นเอ (DNA)
เริ่มต้นจากผลงานของ ออสวอลด์ เอเวอรี (Oswald Avery) คอลิน แมคลีออด (Colin
MacLeod) และ แมคลีน แมคคาที (Maclyn McCarty) ในปี ค.ศ. 1944
ผู้ซึ่งนำดีเอ็นเอจากเชื้อแบคทีเรียนิวโมคอกคัส (pneumococcus) ชนิดรุนแรง
ไปใส่ในเชื้อชนิดไม่รุนแรงทำให้กลาย (transform) เป็นเชื้อชนิดรุนแรงได้
ผลการทดลองของ มาร์ธา เชส (Martha Chase) และ อัลเฟรด เฮิร์สชี (Alfred Hershey)
ในปี ค.ศ. 1952 ผู้ซึ่งได้รับรางวัลโนเบล ในปี ค.ศ. 1969
เป็นการพิสูจน์ขั้นสมบูรณ์ว่าดีเอ็นเอเป็นตัวส่งผ่านลักษณะพันธุกรรมจากสิ่งมีชีวิตรุ่นหนึ่งสู่อีกรุ่นหนึ่งมิใช่โปรตีน
จากการทดลองด้วยการติดฉลากโปรตีนและดีเอ็นเอในไวรัสของแบคทีเรีย (bacteriophage)
ด้วยสารกัมมันตรังสี คือติดฉลากโปรตีนด้วย ซัลเฟอร์-35 (35 S)
และดีเอ็นเอด้วยฟอสฟอรัส-32 (32P) เมื่อนำไวรัสนี้ไปเลี้ยงรวมกับแบคทีเรีย
ดีเอ็นเอที่ติดฉลากสารกัมมันตรังสีจะเข้าสู่เซลล์แบคทีเรีย
ส่วนโปรตีนจะอยู่ภายนอกเซลล์ นอกจากนี้ดีเอ็นเอที่ติดฉลากสารกัมมันตรังสีเท่านั้น
(ไม่ใช่โปรตีน) ที่สามารถจะส่งผ่านจากไวรัสรุ่นหนึ่ง (parents) ไปยังอีกรุ่นหนึ่ง
(offspring) ได้
โครงสร้างเกลียวคู่ของดีเอ็นเอ (DNA double
helix) ประกอบด้วยสาย ซึ่งมีอณูของนิวคลีโอไทด์ น้ำตาลดีออกซีไรโบส และหมู่ฟอสเฟต
เป็นองค์ประกอบสองเส้น โดยนิวคลีโอไทด์มีเบสสี่ชนิดคือ adenine (A), guanine (G),
cytosine (C), และ thymine (T) ซึ่ง A จับเข้าคู่กับ T และ C จับเข้าคู่กับ G เสมอ
ค้นพบโดย ฟรานซีส คริก (Francis Crick) และ เจมส์ วัตสัน (James Watson) ในปี ค.ศ.
1953 ซึ่งได้รับรางวัลโนเบลปี ค.ศ.1962 ร่วมกับ มูรีส วิลคินส์ (Maurice Wilkins)
ผู้ซึ่งทำการศึกษาโครงสร้างสามมิติของดีเอ็นเอด้วยรังสีเอ็กซ์เรย์ (X-ray)
โครงสร้างเกลียวคู่นี้บ่งบอกถึงกลไกการสร้างโดยสำเนา (copying mechanism)
ตัวเองของอณูดีเอ็นเอด้วย
ในปี ค.ศ. 1949 ไรนัส พอลิง (Linus
Pauling) เป็นคนแรกที่กล่าวว่าโรคโลหิตจางซิกเกิลเซลล์ (sickle cell anemia) เป็น “
โรคอณู (molecular disease)” โรคนี้เกิดจากความผิดปกติของฮีโมโกบิน (hemoglobin)
ซึ่งได้มีการพิสูจน์ต่อมาในปี ค.ศ.1956 โดยเวอร์นอน อินแกรม (Vernon
Ingram)
โจ ฮิน ทจิโอ (Joe Hin Tjio)
นักวิทยาศาสตร์ชาวอินโดนีเซีย ซึ่งไปอยู่ในประเทศสหรัฐอเมริกา
เป็นผู้ที่สามารถนับจำนวนโครโมโซมมนุษย์ได้อย่างถูกต้องว่ามี 46 โครโมโซม ในปี ค.ศ.
1955 จากที่มีความเชื่ออย่างผิดๆ กันมานานถึง 30 ปี ว่ามี 48
โครโมโซม
การสร้างเพื่อจำลองตัวแบบกึ่งอนุรักษ์
(semiconservative replication) ของดีเอ็นเอโดยแต่ละข้างของสายเดิม (parent strand)
ถูกใช้เป็นแม่พิมพ์ (template) สำหรับสร้างสายใหม่ (new strand)
ซึ่งสุดท้ายได้ดีเอ็นเอสองคู่ โดยแต่ละคู่ประกอบด้วยสายเดิมและสายใหม่ อย่างละเส้น
ค้นพบโดยแม็ทธิว เมเซลสัน (Matthew Meselson) และแฟรงคลิน สเตล (Franklin Stahl)
ในปี ค.ศ. 1958
ในปี ค.ศ. 1959 เจอโรม เลอเจอร์ (Jerome
Lejeune) และคณะ พบว่ากลุ่มอาการดาวน์ซินโดรม (Down syndrome) ซึ่งพบมาตั้งแต่ปี
ค.ศ. 1866 โดย เจ เอล เอ็ช ดาวน์ (J.L.H Down) เกิดจากไตรโซมี 21 (trisomy 21)
ซึ่งมีโครโมโซม 21 จำนวน 3 โครโมโซม (แทนที่จะมีจำนวนตามปรกติ 2 โครโมโซม)
จำนวนชุดของยีนบนโครโมรโซม 21 ที่เพิ่มขึ้น
มีผลต่อการพัฒนาการของทั้งสมองและร่างกาย
ในปี ค.ศ. 1961
โรเบิร์ต กัตทรี (Robert Guthrie) ค้นพบวิธีตรวจภาวะผิดปรกติทางเมตาบอลิค
(metabolic defect) ในเด็กแรกเกิด ที่เรียกว่า ฟีนิวคีโตนูเรีย (phenylketonuria
หรือ PKU) ซึ่งเป็นภาวะที่เด็กมีกรดอะมิโนฟีนิวอะลานีน (phenyalanine) สูงในเลือด
เป็นอันตรายและทำให้พัฒนาการของสมองผิดปรกติ (mental retardation)
การตรวจทำโดยนำแบคทีเรียที่ไม่สามารถสร้างฟีนิวอะลานีนมาใช้เป็นตัวทดสอบในปีเดียวกัน
ซิดนีย์ เบรนเนอร์ (Sydney Brenner) ฟรังซัว จาคอบ (Francois Jacob) และแม็ทธิว
เมเซลสัน (Matthew Meselson) พบบทบาทของไรโบนิวคลีอิก แอซิด หรือ อาร์เอ็นเอ
(ribonucleic acid หรือ RNA) ว่าเป็นอณูซึ่งทำหน้าที่นำข้อมูลพันธุกรรม (genetic
information) จากดีเอ็นเอในนิวเคลียส (nucleus) มาสู่ซัยโตปลาสซึม (cytoplasm)
และเซลล์ใช้เอ็ม-อาร์เอ็นเอ (mRNA) เพื่อสังเคราะห์โปรตีน การถอดรหัสพันธุกรรม
(genetic code) ทำได้สำเร็จโดยคณะนักวิทยาศาสตร์นำโดย มาร์แชลล์ ไนเรนเบิร์ก
(Marshall Nirenberg) ฮาร์ โครานา (Har Khorana) และซีวีโร โอเชา (Severo Ochoa)
ในปี ค.ศ. 1966 โดยแสดงให้เห็นว่ากรดอะมิโน (amino acid) แต่ละชนิด จากจำนวนทั้งหมด
20 ชนิด ถูกกำหนดโดยรหัสที่มาจากลำดับของนิวคลีโอไทด์เบส (nucleotide base) สามตัว
การเรียงลำดับของเบสสามตัวนี้เรียกว่า “โคดอน (codon)”
ในช่วงทศวรรษ 1970-90 เป็นยุคแห่งการวางรากฐานของเทคโนโลยีดีเอ็นเอ (DNA
technology) มีการค้นพบที่สำคัญหลายอย่าง คือ การค้นพบเอนไซม์ตัดจำเพาะ
(restriction endonuclease enzyme) ตัวแรก ในปี ค.ศ. 1968 โดย เอ็ช โอ สมิท (H. O.
Smith) เค ดับเบิลยู วิลค็อก (K. W. Wilcox) และ ที เจ เคลลี (T. J.
Kelley) การสร้างดีเอ็นเอสายผสม (recombinant DNA) สำเร็จเป็นครั้งแรก ในปี
ค.ศ. 1972 โดยสแตนลีย์ โคเฮ็น (Stanley Cohen) และเฮอร์เบิร์ต บอยเออร์
(Herbert Boyer) และการค้นพบเอนไซม์ สำหรับสร้างดีเอ็นเอกลับจากอาร์เอ็นเอ
(reverse transcriptase) โดย ดี บัลติมอร์ (D. Baltimore) และ เอ็ช เอ็ม เทมิน (H.
M. Temin) ในปี ค.ศ. 1970
การคิดค้นวิธีหาลำดับนิวคลีโอไทด์ของดีเอ็นเอที่รวดเร็วได้สำเร็จ
โดยเฟรดเดอริก แซงเกอร์ (Frederic Sanger) เอ เอ็ม เม็กแซม (A. M. Maxam) และ
ดับเบิลยู กิลเบิร์ต (W. Gilbert) ในปี ค.ศ. 1977
ในปี ค.ศ.
1978 วาย ดับเบิลยู คาน (Y W. Kan) และ เอ เอ็ม โดซี (A. M. Dozy)
ได้แสดงให้เห็นคุณค่าของการใช้ความหลากหลายในความยาวของดีเอ็นเอที่ตัดด้วยเอนไซม์ตัดจำเพาะ
(restriction fragment-length polymorphism) หรือ RFLPs)
เป็นตัวติดตามการถ่ายทอดร่วม (linked marker)
สำหรับการวินิจฉัยก่อนคลอดของโรคโลหิตจางซิกเกิลเซลล์ (sickle cell anemia)
นอกจากนี้ เดวิท บ็อทส์ตีน (David Botstein) ยังพบว่าอาร์เอฟเอลพี (RFLPs)
ซึ่งมีการกระจายทั่วไปในจีโนม มีประโยชน์สำหรับใช้เป็นตัวติดตามการถ่ายทอดร่วม
(linkage) ในการศึกษาพันธุศาสตร์ของมนุษย์
การค้นพบนี้เป็นจุดตั้งต้นของการค้นหาและทำแผนที่ของยีนบนโครโมโซมมนุษย์ (human
genetic mapping) โดยการใช้อาร์เอฟแอลพี
ยีนที่สามารถค้นหาและทำแผนที่บนโครโมโซมมนุษย์ได้สำเร็จเป็นยีนแรกโดยวิธีนี้ในปี
ค.ศ. 1983 คือ ยีนที่ทำให้เกิดโรคฮันติงตัน (Huntingtion disease)
ซึ่งอยู่บนแขนข้างสั้นของโครโมโซมคู่ที่ 4 ลายพิมพ์ดีเอ็นเอ (DNA
fingerprinting) ค้นพบโดยอเล็ก เจฟฟี่ (Alec Jeffreys) ในปี ค.ศ. 1984
มีประโยชน์ทางนิติวิทยาศาสตร์ (Forensic science)
ในการตรวจยืนยันตัวบุคคลและความเป็นพ่อแม่และลูก
เทคนิคในการสงเคราะห์ดีเอ็นเอในหลอดทดลองด้วยปฏิกิริยาลูกโซ่โพลีเมอเรส
(polymerase chain reaction หรือ PCR) ได้มีการค้นพบและรายงานในปี ค.ศ. 1985
โดยแครี่ มัลลีส (Kary Mullis) และคณะ ซึ่งทำงานที่บริษัทซีตัส คอร์ปอเรชั่น (Cetus
Corporation)
เป็นเทคนิคที่ก่อให้เกิดการปฏิวัติทางด้านอณูชีววิทยามากที่สุด
ในปี ค.ศ. 1987 ได้มีการทำแผนที่ตำแหน่งอาร์แอฟแอลพีในจีโนมมนุษย์ทั้งหมด 400
ตำแหน่งเป็นครั้งแรก (first human genetic map)
ความสามารถในการศึกษาดีเอ็นเอของมนุษย์โดยตรง เพื่อค้นหาและทำแผนที่ยีนบนโครโมโซม
ทำให้มีพัฒนาและคิดค้นวิธีแยกยีนจากตำแหน่งบนโครโมโซม (positional cloning)
ได้สำเร็จในปี ค.ศ. 1989 และมีการนำมาใช้กับยีนที่เป็นสาเหตุของโรคหลายชนิด
โรคแรกได้แก่ โรคโครนิกแกรนูโนมาตัส (chronic granulomatous disease)
ซึ่งเป็นโรคที่มีก้อนอักเสบจากการรวมกลุ่มของเซลล์เม็ดเลือดขาวฟาโกซัยต์
(phagocyte) ต่อมามีการแยกยีนด้วยวิธีนี้สำเร็จเพิ่มขึ้นในโรคกล้ามเนื้อลีบดูเช็นน์
(Duchenne muscular dystrophy) และโรคมะเร็งในดวงตาชนิดเรติโนบลาสโตมา
(retinoblastoma)
ในปี ค.ศ. 1989
ประเทศสหรัฐอเมริกาได้จัดตั้งศูนย์วิจัยจีโนมมนุษย์แห่งชาติ (National Center for
Human Genome Research) ซึ่งอำนวยการโดยเจมส์ วัตสัน
เพื่อดูแลการดำเนินงานโครงการจีโนม-มนุษย์ (The Human Genome Project)
ซึ่งจะทำแผนที่ยีนและหาลำดับนิวคลีโอไทด์ในดีเอ็นเอของมนุษย์ทั้งหมด
รวมทั้งสิ่งมีชีวิตที่เป็นต้นแบบ (model organisms) โครงการนี้ใช้งบประมาณ 3
พันล้านเหรียญสหรัฐ ในระยะเวลา 15 ปี มีกำหนดอย่างเป็นทางการในปี ค.ศ. 1990
คาดว่าจะดำเนินการสำเร็จในปี ค.ศ. 2005 เป็นโครงการที่มีการวางแผนอย่างดี
และมีการศึกษาวิจัยผลกระทบทางด้านต่างๆ โดยเฉพาะจริยธรรม กฎหมาย และสังคม
(Ethical,legal,and social implications หรือ ELSI)
ควบคู่ไปกับโครงการนี้ด้วย
โครงการจีโนมมนุษย์
โครงการจีโนมมนุษย์
เป็นความร่วมมือระดับนานาชาติที่จะทำการหาลำดับนิวคลีโอไทด์ทั้งหมดของดีเอ็นเอ
(จำนวน 3.2 พันล้านนิวคลีโอไทด์) และทำแผนที่ยีนทั้งหมดบนโครโมโซมของมนุษย์
โครงการนี้ดำเนินการได้เร็วกว่าแผน
ได้ประกาศความสำเร็จการทำโครงร่างลำดับนิวคลีโอไทด์ของมนุษย์ (draft sequence of
the human genome) เมื่อวันที่ 26 มิถุนายน ค.ศ. 2000
โดยได้มีการตีพิมพ์ผลการศึกษาในวารสารเนเจอร์ (Nature) และซายส์ (Science)
เมื่อวันที่ 15 และ 16 กุมภาพันธ์ 2001 ตามลำดับ และโครงการสำเร็จลงในปี ค.ศ. 2003
ซึ่งเร็วกว่ากำหนด 2 ปี
การหาลำดับนิวคลีโอไทด์และค้นหายีนในระยะสุดท้ายของโครงการ
ดำเนินการโดยกลุ่มวิจัย 2 กลุ่ม กลุ่มแรก คือ กลุ่มร่วมมือนานาชาติ (International
Human Genome Sequencing Cosortium หรือ IHGSC) ประกอบด้วยห้องปฏิบัติการ 20 แห่ง
ในประเทศสหรัฐอเมริกา อังกฤษ ญี่ปุ่น ฝรั่งเศส เยอรมัน และจีน
ได้รับการสนับสนุนงบประมาณจากรัฐบาลของตนเอง และองค์กรสาธารณะ (เช่น Welcome Trust
ของประเทศอังกฤษ)
ใช้วิธีสร้างแผนผังของชิ้นดีเอ็นเอขนาดใหญ่ก่อนที่จะดำเนินการหาลำดับนิวคลีโอไทด์
(hierarchical shotgun sequencing method) กลุ่มที่สอง คือ บริษัทเซเลรา จีโนมิกส์
(Celera Genomics) ร่วมกับมหาวิทยาลัยต่างๆ ในสหรัฐอเมริกา
ใช้วิธีหาลำดับนิวคลีโอไทด์ของชิ้นดีเอ็นเอขนาดเล็กจำนวนมากแบบซุ่ม (random shotgun
sequencing) จากนั้นจึงใช้คอมพิวเตอร์ในการจัดเรียง (assembly) ลำดับนิวคลีโอไทด์
โดยการอาศัยความซ้ำซ้อนที่ส่วนปลายของชิ้นดีเอ็นเอมาช่วยจัดเรียงและต่อกัน
ทั้งสองกลุ่มได้ประกาศความสำเร็จร่วมกัน
ในการหาลำดับนิวคลีโอไทด์ของจีโนมมนุษย์ได้เกือบทั้งหมด (ประมาณ 94 %)
โครงการศึกษาจีโนมของมนุษย์เสร็จในปี ค.ศ. 2003 ตรงกับการเฉลิมฉลอง 50 ปี (50th
anniversary) ของการค้นพบโครงสร้างของดีเอ็นเอโดยฟรานซีส คริก และเจมส์
วัตสัน
มนุษยพันธุศาสตร์ในยุคจีโนมิกส์
ผลของโครงการจีโนมมนุษย์ ทำให้มีข้อมูลลำดับนิวคลีโอไทด์ของจีโนมมนุษย์
ตำแหน่งและรายละเอียดของยีนทั้งหมด ซึ่งมีอยู่ประมาณ 30,000 ยีน
รู้ลำดับนิวคลีโอไทด์ของอาร์เอ็นเอ และลำดับของ กรดอะมิโนของโปรตีนทั้งหมด
นอกจากนี้ ยังมีการศึกษาจีโนมของสิ่งมีชีวิตที่เป็นต้นแบบ (model organisms)
เพื่อเปรียบเทียบทำให้ได้ข้อมูลลำดับนิวคลีโอไทด์ ตำแหน่งและรายละเอียดของยีน
ลำดับ นิวคลีโอไทด์ของอาร์เอ็นเอ และลำดับกรดอะมิโนของโปรตีนทั้งหมด
เช่นเดียวกับของมนุษย์ ความรู้เหล่านี้ทำให้เกิดศาสตร์ใหม่เรียกว่า
“จีโนมิกส์ (Genomics)” ซึ่งประกอบด้วยความรู้ในสามแนวทาง
คือ
1. จีโนมิกส์เชิงโครงสร้าง (structural genomics)
เป็นความรู้ทางด้านโครงสร้างของจีโนม ได้แก่ ลำดับนิวคลีโอไทด์ของดีเอ็นเอ
ตำแหน่งและรายละเอียดของยีน ลำดับนิวคลีโอไทด์ของอาร์เอ็นเอ
และลำดับกรดอะมิโนของโปรตีนทั้งหมด
2.
จีโนมิกส์เชิงหน้าที่ (functional genomics)
เป็นความรู้ในเรื่องหน้าที่ของจีโนมหรือของยีนทั้งหมดในจีโนม
เกี่ยวข้องกับอาร์เอ็นเอ ทรานสคริป (RNA transcript)
และโปรตีนทั้งหมด
3.
จีโนมิกส์เชิงเปรียบเทียบหรือวิวัฒนาการ (comparative or evolutionary genomics)
เป็นความรู้จากการเปรียบเทียบศึกษาเปรียบเทียบจีโนมของสิ่งมีชีวิตต่างๆ
เพื่อให้เข้าใจสายสัมพันธ์ทางวิวัฒนาการ
ความรู้ทางด้านจีโนมิกส์ร่วมกับเทคโนโลยีที่ได้รับการพัฒนาให้มีประสิทธิภาพมากขึ้น
และความรู้ทางด้านชีวสารสนเทศ (Bioinformatics)
ทำให้สามารถวิเคราะห์ข้อมูลจำนวนมากได้ในเวลาอันรวดเร็วส่งผลให้เกิดศาสตร์หรือความรู้ใหม่ที่เกี่ยวข้อง
คือ
ความรู้ในเรื่องการแสดงออกของยีนทั้งหมดจากจีโนมซึ่งได้จากการศึกษาเอ็ม-อาร์เอ็นเอทั้งหมด
เรียกว่า “ทรานสคริปโตมิกส์ (Transcriptomics)”
และความรู้ในเรื่องการแสดงออกของยีนทั้งหมดจากจีโนม
ซึ่งได้จากการศึกษาโปรตีนทั้งหมด เรียกว่า “โปรตีโอมิกส์ (Proteomics)”
นอกจากนี้ในปัจจุบันยังมีศักยภาพทางด้านเทคโนโลยีที่จะทำการศึกษาสารเมตาบอไลท์
(metabolites) และวิถีเมตาบอลิสึมต่างๆ เรียกว่า “เมตาบอโลมิกส์ (Metabolomics)”
(ดูรูปที่1)
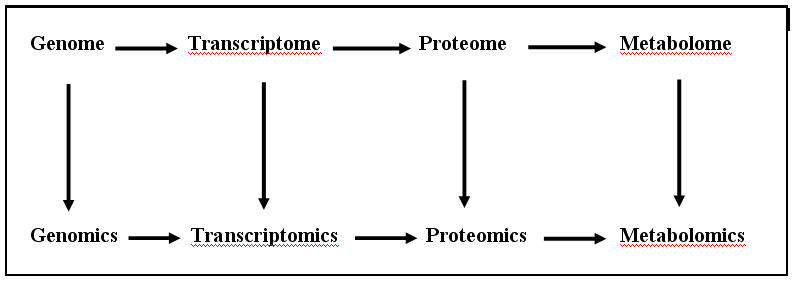
รูปที่ 1 ความสัมพันธ์ระหว่างจีโนม (genome) ทรานสคริปโตม (transcriptome) โปรตีโอม (proteome) และเมตาบอโลม (metabolome) และศาสตร์ที่ศึกษาในเรื่องเหล่านี้ คือ จีโนมิกส์ (Genomics) ทรานสคริปโตมิกส์ (Transcriptomics) โปรตีโอมิกส์ (Proteomics) และเมตาบอโลมิกส์ (Metabolomics)
ด้วยความรู้ใหม่ดังกล่าว ร่วมกับประสิทธิภาพในการรวบรวม
วิเคราะห์ และสังเคราะห์ ข้อมูลด้วยคอมพิวเตอร์และชีวสารสนเทศ
ทำให้เกิดศาสตร์ใหม่ที่รวมศาสตร์อื่นๆ ไว้ เรียกว่า “ชีววิทยาเชิงระบบ (System
Biology)” ซึ่งมุ่งที่จะทำการวิเคราะห์ความสัมพันธ์ขององค์ประกอบในระบบ
เมื่อมีการรบกวนหรือเปลี่ยนแปลงทั้งทางด้านพันธุกรรมและสิ่งแวดล้อม
โดยมีจุดมุ่งหมายที่จะทำความเข้าใจระบบหรือคุณสมบัติใหม่ที่เกิดขึ้นจากผลกระทบ
โดยระบบอาจจะประกอบด้วยโปรตีนเพียง 2-3 ชนิด
ซึ่งทำหน้าที่จำเพาะในวิถีเมตาบอลิซึมหนึ่ง (เช่น galactose metabolism)
เรียกว่าไบโอโมดูล (biomodule) หรือประกอบด้วยโปรตีนหลายชนิดและอณูอื่นๆ
ทำงานร่วมกันเป็นจักรกลระดับอณู (molecular machine) เช่น ไรโบโซม (ribosome)
หรือเป็นเครือข่ายของโปรตีน (protein network)
ที่ปฏิบัติงานร่วมกันเพื่อทำหน้าที่สำคัญของเซลล์ เช่น ทำให้เซลล์คงรูปร่าง
หรือระบบอาจจะประกอบด้วยเซลล์หรือกลุ่มเซลล์ที่ทำหน้าที่ให้ปรากฎเป็นลักษณะจำเพาะ
ดังนั้นระบบชีววิทยา (biological system) อาจจะประกอบด้วยอณู (molecules) เซลล์
(cell) อวัยวะ (organs) สิ่งมีชีวิตแต่ละชนิด (individuals) หรือแม้แต่ระบบนิเวศน์
(ecosystems) ก็ได้
จีโนมของมนุษย์ จีโนมิกส์
และการประยุกต์
จีโนมมนุษย์ (human genome) คือ
คัมภีร์ชีวิต (The Book of Life) ที่รวบรวมข้อมูลรหัสพันธุกรรมสำหรับสร้างมนุษย์
ควบคุมพัฒนาการ ลักษณะรูปร่าง และการทำงานของอวัยวะและระบบของร่างกาย
ซึ่งประกอบขึ้นเป็นชีวิต นอกจากนี้ จีโนมยังกำหนดความมีสุขภาพดี ความเจ็บป่วย
และอายุขัย อีกทั้งยังเป็นบันทึกดึกดำบรรพ์ (palaeontological record)
ของวิวัฒนาการมนุษย์ (human evolution) การอ่านและถอดรหัสดีเอ็นเอทั้งหมด
ซึ่งเป็นองประกอบของจีโนมมนุษย์ จึงมีความสำคัญในทางชีววิทยาและการแพทย์
เพราะทำให้เข้าใจชีววิทยาของมนุษย์ (human biology) ภาวะปกติและผิดปกติของร่างกาย
สมุฏฐานของโรค ปฎิสัมพันธ์ระหว่างพันธุกรรมกับสิ่งแวดล้อม วิวัฒนาการ
และสายสัมพันธ์ทางวิวัฒนาการของมนุษย์กับสิ่งมีชีวิตอื่น
จีโนมมนุษย์ (human genome) ประกอบด้วย 24 โครโมโซม มียีนประมาณ 30,000 ยีน
และมีลำดับนิวคลีโอไทด์ประมาณ 3.2 พันล้านนิวคลีโอไทด์
จากข้อมูลการศึกษาจีโนมมนุษย์ทำให้ทราบว่า ในจีโนมมนุษย์
มีความไม่สม่ำเสมอในการกระจายตัวของ ยีน และส่วนประกอบอื่นๆ (เช่น transposable
elements, GC content, CpG islands) บริเวณที่มียีนมากในจีโนมมนุษย์
คือบริเวณที่มีนิวคลีโอไทด์ชนิด G และ C (GC-rich region)
ส่วนบริเวณที่ยีนน้อยหรือไม่ค่อยมียีน คือ บริเวณที่มีนิวคลีโอไทด์ชนิด A และ T
(AT-rich region) ซึ่งทั้งสองบริเวณนี้ ปรากฏเป็นแถบติดสีจาง (light band)
และสีเข้ม (dark band) บนโครโมโซม
ในแต่ละโครโมโซมและแต่ละบริเวณจะมีส่วนประกอบที่เป็น G และ C (GC content)
แตกต่างกัน โดยเฉลี่ยทั้งจีโนมมีปริมาณจีซี (GC content) ร้อยละ
41
ในจีโนมมนุษย์มียีนทั้งหมดประมาณ 30,000 ยีน
(หรืออาจจะน้อยกว่า) ซึ่งมีจำนวนน้อยกว่าที่เคยประมาณการไว้มาก
แสดงว่ามนุษย์มีความมัธยัสถ์อย่างยิ่งในการใช้ยีน
สามารถใช้ยีนที่มีจำนวนน้อยให้ได้ประโยชน์มากกว่าสิ่งมีชีวิตอื่น
เพราะแทนที่จะใช้หนึ่งยีนสำหรับหนึ่งโปรตีน
กลับใช้หนึ่งยีนสำหรับสังเคราะห์โปรตีนหลายชนิด โดยอาศัยกลไกเลือกตัดต่ออาร์เอ็นเอ
(alternative splicing) เพื่อเลือกสรรส่วนชิ้นส่วนของโปรตีนมารวมกัน
กลไกนี้เกิดขึ้นได้ เนื่องจากยีนของมนุษย์แผ่ออกเป็นบริเวณกว้างใน จีโนมิกส์
ดีเอ็นเอ (genomic DNA) และบริเวณที่ใช้เป็นรหัสสังเคราะห์โปรตีน (coding region)
ของยีน มักจะไม่ต่อเนื่องกัน ทำให้หนึ่งยีนสามารถสร้างโปรตีนได้แตกต่างกัน
โดยเฉลี่ยหนึ่งยีนของมนุษย์ สังเคราะห์โปรตีนได้ประมาณสามชนิด
ซึ่งมากกว่าหนอนตัวกลมและแมลงหวี่สามารถสังเคราะห์ได้
โปรตีโอม (proteome) ซึ่งสร้างจากจีโนมมนุษย์และสัตว์ที่มีกระดูกสันหลัง
(vertebrate) มีความซับซ้อนมากกว่าโปรตีโอมของสัตว์ที่ไม่มีกระดูกสันหลัง
(invertebrate) มนุษย์และสัตว์ที่มีกระดูกสันหลัง ใช้วิธีนำชิ้นส่วนของโปรตีน
(protein domain) ที่มีอยู่แล้วในสิ่งมีชีวิตอื่นในวิวัฒนาการ
มาจัดเรียงให้กลายเป็นโปรตีนที่มีโครงสร้างใหม่ หรืออีกนัยหนึ่ง
มนุษย์ประสบความสำเร็จในการจัดเรียงสิ่งที่สิ่งมีชีวิตอื่นทดสอบมาแล้วว่าใช้ได้ให้เป็นของใหม่และเพิ่มชนิดขึ้น
โดยไม่ได้ใช้วิธีสร้างขึ้นใหม่เองทั้งหมด
ในมนุษย์มีการเพิ่มขึ้นของจำนวนกลุ่มหรือตระกูลโปรตีน (protein families)
และพบว่าประมาณร้อยละ 60 ของกลุ่มโปรตีนของมนุษย์จะอยู่ในตระกูลใหญ่ (superfamiles)
ที่มีสมาชิกของกลุ่มมากกว่าในสิ่งมีชีวิตชนิดอื่น
แสดงถึงกลไกการทำให้เกิดยีนเดิมซ้ำ (gene duplication)
เป็นแรงขับเคลื่อนทางวิวัฒนาการ (evolutionary drive)
ที่สำคัญในมนุษย์และสัตว์มีกระดูกสันหลัง
ลำดับนิวคลีโอไทด์ของจีโนมมนุษย์จากเชื้อชาติต่างๆ ที่มีการศึกษา มีความเหมือนกัน
ร้อยละ 99.9 ส่วนที่แตกต่างกันร้อยละ 0.1 เกิดขึ้นโดยเฉลี่ย 1 ในทุกๆ 1,000
นิวคลีโอไทด์ ทำให้แต่ละคนแตกต่างกัน และเป็นพื้นฐานพันธุกรรม (genetic basis)
ของการเกิดโรค เป็นนิวคลีโอไทด์ที่มีความแตกต่างในตำแหน่งใดต่ำแหน่งหนึ่ง
เพียงแห่งเดียว (เรียกว่า single nucleotide polymorphism หรือ SNP ซึ่งออกเสียงว่า
สนิป) ซึ่งมี 1.4-2.1 ล้านแห่ง (หรืออาจจะมากกว่านี้)
โดยทราบตำแหน่งที่แน่นอนของแต่สนิปในจีโนมมนุษย์ด้วย
สนิปไม่ได้มีการกระจายอย่างสม่ำเสมอและในจำนวนที่เท่าเทียมกันตลอดจีโนมมนุษย์
ในบางบริเวณปราศจากสนิป แต่บางบริเวณมีเป็นจำนวนมาก
บริเวณที่มีสนิปน้อยอาจจะเกิดจากวิวัฒนาการที่คัดเลือกยีนที่มีรูปแบบ (form)
หนึ่งไว้ตลอดระยะเวลาอันยาวนาน ตัวอย่างเช่น พบว่ามีสนิป น้อยในโครโมโซม-เอ็กซ์
แต่มีมากในบริเวณ HLA region
ซึ่งควบคุมการสังเคราะห์โปรตีนพบผิวเซลล์เม็ดเลือดขาวและเกี่ยวข้องกับการสร้างภูมิคุ้มกัน
ความรู้ทางด้านจีโนมิกส์ของมนุษย์จะนำไปสู่ความเข้าใจพื้นฐานการเกิดโรคในระดับอณู
โดยเฉพาะโรคที่มีสาเหตุทางพันธุกรรมซับซ้อน (complex polygenic disease)
ซึ่งเป็นโรคที่พบบ่อย (common diseases) เช่น โรคเบาหวาน โรคหัวใจ ความดันโลหิตสูง
มะเร็ง โรคจิต เป็นต้น
นอกจากนี้ยังทำให้เข้าใจลักษณะความแตกต่างทางพันธุกรรมที่ทำให้เกิดโรคง่าย (genetic
susceptibility) ในภาวะที่สัมผัสกับสิ่งแวดล้อมและปัจจัยเสี่ยงบางอย่าง เช่น อาหาร
สารเคมี การติดเชื้อ หรือสิ่งซึ่งอาจจะมีผลต่อสุขภาพตั้งแต่อยู่ในครรภ์
ความรู้เหล่านี้สามารถนำมาใช้ในการวินิจฉัยและทำนายการเกิดโรค
เพื่อหลีกเหลี่ยงป้องกันปัจจัยเสี่ยงต่างๆ
นอกจากนี้ความรู้ความเข้าใจโดยละเอียดและถูกต้องเกี่ยวกับกลไกการเกิดโรคในระดับยีนและโปรตีน
ทำให้สามารถพัฒนายาใหม่ๆ ที่มีประสิทธิภาพ
และมีผลไปทำปฏิกิริยาหรือยับยั้งการทำงานของยีน
เอนไซม์หรือโปรตีนที่เป็นเป้าหมายในการรักษาอย่างจำเพาะและโดยตรง
ร่วมกับการรักษาโดยใช้ข้อมูลพื้นฐานทางพันธุกรรมของแต่ละบุคลมาประกอบ
ทำให้การรักษามีความถูกต้อง เหมาะสมและได้ผลในแต่ละบุคคล (individualized
therapy)
ความรู้ความก้าวหน้าทางด้านจีโนมและจีโนมิกส์
อาจจะเกิดผลกระทบในทางลบขึ้นได้ หากมีการนำมาใช้อย่างไม่ถูกต้อง ระมัดระวัง
และเหมาะสม เช่น การนำมาใช้โดยขาดความรู้ หรือการนำมาใช้โดยมุ่งประโยชน์ทางการค้า
เช่น
การตรวจวิเคราะห์ดีเอ็นเออาจจะถูกนำมาใช้โดยบริษัทประกันหรือนายจ้างเพื่อปฏิเสธการรับประกันหรือการจ้างงาน
เป็นต้น ผลกระเชิงลบเหล่านี้ จำเป็นต้องมีระเบียบ กฎเกณฑ์ และกฏหมาย
ที่จะควบคุมและป้องกัน เพื่อให้ความรู้และก้าวหน้าในด้านนี้
เกิดประโยชน์และคุณค่าแก่มนุษย์ สังคม
และสิ่งแวดล้อมอย่างแท้จริง
บรรณานุกรม
1. เพทาย เย็นจิตโสมนัส, บุรชัย สนธยานนท์. โครงการศึกษาจีโนมของมนุษย์ .ใน
พันธุศาสตร์ยุคใหม่ : รวมผลงานสัมมนาวิชาการพันธุศาสตร์ ครั้งที่ 8, ดาวรุ่ง
กังวานพงศ์, วิสุทธิ์ ใบไม้ (บรรณาธิการ), นิวธรรมดาการพิมพ์ 2537, หน้า
78-96
2. Collins F, Galas D. A new five-year plan
for the U.S. human genome project. Science 1993;
252:43-46.
3. Duboule D. The evolution of genomics
(Editorial). Science 1997;278:555.
4. Hieter P,
Boguski M. Functional genomics : it,s all how you read it. Science
1997;278:601-602.
5. Collins FS, Patrinos A, Jordan
E, Chakravarti A, Gesteland R, Walters L, the members of the DOE and NIH
planning groups. New goals for the U.S. human genome project : 1998-2003.
Science 1998;282:682-689.
6. Collins FS, Shattuck
Lecture-Medical and societal consequences of the human genome project. New Engl
J Med 1999; 341: 28-37.
7. Bentley DR. The Human
Genome Project-an overview. Med Res Rev. 2000; 20:
189-96.
8. Childs B, Valle D. Genetics, biology and
disease. Annu Rev Genomics Hum Gent 2000; 1: 1-19.
9. Crow JF. Two centuries of genetics: a view from halftime. Annu Rev Genomics
Hum Genet 2000; 1:21-40.
10. International Human Genome
Sequencng Consortium. Initial sequencng and analysis of the human genome.
Nature 2001; 409:860-921.
11. Venter C, Adams M,
Myers E, Li W, Mural R, Sutton G, et al. The sequence of the human genome.
Science 2001; 291 : 1304 – 1351.
12. Shastry BS. SNP
alleles in human disease and evolution. J Hum Genet
2002;47:561-6.
13. Guttmacher AE, Collins FS. Welcome to
the genomic era. N Engl J Med 2003;349:996-8.
14. Collins
FS, Green ED, Guttmacher AE, Guyer MS; US National Human Genome Research
Instiute. A vision for the future of genomics research. Nature
2003;422:835-47.
15. Hood L, Galas D. The digital code of
DNA. Nature 2003;421:444-8.
16. Austin CP. The impact of
the completed human genome sequence on the development of novel
therpeutics for human disease. Annu Rev Med 2004;55:1-13.
17. Weston AD, Hood L. Systems biology proteomics, and the future of health
care: toward predictive, preventative, and personalized medicine. J
Proteome Res 2004; 3:179-96.
แหล่งที่มา
ปรับแก้ไขมาจากบทความในหนังสือ
การประชุมวิชาการพันธุศาสตร์แห่งชาติ ครั้งที่ 14 พันธุศาสตร์ :
จากพื้นฐานสู่เทคโนโลยีระดับโมเลกุล
เพทาย เย็นจิตโสมนัส. 2548.
มนุษยพันธุศาสตร์ในยุคจีโนมิกส์. การประชุมวิชาการพันธุศาสตร์แห่งชาติ ครั้งที่ 14
พันธุศาสตร์ : จากพื้นฐานสู่เทคโนโลยีระดับโมเลกุล. 11 – 13 มีนาคม 2548.
กรุงเทพมหานคร : โรงแรม มิราเคิล แกรนด์ คอนเวนชั่น : XL-LI.
comment
 |
Duchene muscular dystrophy (DMD) สามารถวินิจฉัยเบื้องต้นได้ด้วยอาการทางคลินิก และวินิจฉัยเพื่อยืนยันด้วยการย้อมตรวจเซลล์กล้ามเนื้อด้วยวิธีทางพยาธิวิทยา หรือวิธีตรวจยีนด้วยเทคนิคทางอณูพันธุศาสตร์ ผู้ป่วยโรค DMD ประมาณร้อยละ 60 มีการขาดหายของดีเอ็นเอบางส่วนภายในยีน สามารถจะนำดีเอ็นเอซึ่งสกัดมาจากเลือดผู้ป่วย มาทำการตรวจได้
เพทาย
 |
สวัสดีค่ะ อาจารย์เพทาย
อยากทราบความหมายของคำว่า Biochemical Genetics ค่ะ
เราจะสามารถกล่าวว่าโรคที่เกี่ยวกับความผิดปกติทางพันธุกรรมทุกชนิดเป็น
โรคที่มีความผิดปกติทาง Biochemical Genetics ได้หรือเปล่าคะ
ขอความกรุณาอาจาย์ ยกตัวอย่างให้ดูด้วยนะคะ ขอบพระคุณค่ะ
 |
พันธุศาสตร์เชิงชีวเคมี (Biochemical Genetics) หมายถึงวิชาที่ว่าด้วยการศึกษาโรคหรือความผิดปกติทางพันธุกรรมที่ส่งผลให้เกิดความผิดปกติในระดับของสารเคมี อนุพันธ์ของสารเคมี หรือโปรตีนบางชนิดในร่างกาย ซึ่งโรคหรือความผิดปกติทางพันธุกรรมเหล่านี้เกิดขึ้นจากความผิดปกติหรือมิวเตชันของยีน ทำให้เกิดความผิดปกติของโปรตีน โดยโปรตีนที่ผิดปกติมักจะทำหน้าที่เป็นเอ็นไซม์ (enzyme) ทำหน้าที่เร่งปฏิกิริยาบางอย่างในร่างกาย เมื่อเกิดความผิดปกติของเอ็นไซม์ จะทำให้เกิดการสะสมของสารเคมีที่ต้องอาศัยเอ็นไซม์นั้นในการเปลี่ยนหรือเร่งปฏิกิริยา หรืออาจจะทำให้วิถี (pathway) ของการสร้างหรือทำลายสารบางอย่างเปลี่ยนแปลงไป ตัวอย่างเช่น โรค alkaptonuria ซึ่งเกิดจากความผิดปกติของเอ็นไซม์ homogentisic acid oxidase (ทำหน้าที่เปลี่ยน homogentisic acid เป็น maleylacetoacetic acid) ทำให้มีการคั่งของ homogentisic acid ในร่างกายและมีการขับออกทางปัสสาวะ สารนี้จะมีการเปลี่ยนแปลงและสะสมตามข้อทำให้ข้ออักเสบ หรือโรค phenylketonuria ซึ่งเกิดจากความผิดปกติของเอ็นไซม์ phenylalanine hydroxylase (ทำหน้าที่เปลี่ยน phenylalanine เป็น tyrosine) ทำให้มีการคั่งของ phenylalanine ในร่างกายและมีการขับออกทางปัสสาวะ และโรคนี้จะทำให้เกิดภาวะปัญญาอ่อนได้ โรคในกลุ่มนี้อาจจะเรียกชื่ออีกอย่างหนึ่งว่า inborn errors of metabolism
โรคพันธุกรรมบางอย่างเท่านั้นที่มีความผิดปกติของวิถีเมตาบอลิซึม (metabolism) ทำให้เกิดการสะสมของสารทางชีวเคมีที่สามารถตรวจพบได้และจัดอยู่ในกลุ่มนี้ แม้ว่าโรคพันธุกรรมทุกชนิดจะเกิดจากความผิดปกติของยีนหรือดีเอ็นเอ ซึ่งอาจจะส่งผลถึงอาร์เอ็นเอ โปรตีนและสารต่างๆ แต่ก็ไม่ได้จัดอยู่ในกลุ่มของโรคพันธุกรรมที่เกิดความผิดปกติของสารทางชีวเคมี หรือเกิดความผิดปกติทาง biochemical genetics ซึ่งมีความหมายจำเพาะ
 |
โรคฮันติงตันมีอาการเฉพาะคือการเคลื่อนไหวแบบกระตุกที่ไม่สามารถบังคับควบคุมได้ (jerky, random, and uncontrollable movements) หรือการเคลื่อนไหวที่ไม่ได้ตั้งใจซึ่งไม่มีความสัมพันธ์กันของกล้ามเนื้อ (lack of coordination) เรียกว่าโคเรีย (chorea)
 |


17 June 2009 21:07
#2318
เราจะวินิจฉัยโรค duchenne syndromeได้อย่างไรคะ
ช่วยบอกด้วยไหมคะ